НОВОСТИ КОМПАНИЙ: Применение комбинации препаратов Авастин и Тарцева увеличивает время, в течение которого больные распространенным раком лёгкого могут прожить без прогрессирования заболевания
Сегодня компания Рош объявила предварительные результаты исследования III фазы (ATLAS) у больных немелкоклеточным раком лёгкого (НМРЛ). Исследование было остановлено раньше запланированного срока из-за достоверности полученных промежуточных данных. Его результаты показали, что комбинация Тарцевы (эрлотиниба) и Авастина (бевацизумаба), применяемых в качестве поддерживающей терапии первой линии после комбинированного лечения химиопрепаратами и Авастином, увеличивает время, в течение которого больные раком могут прожить без прогрессирования заболевания (выживаемость без прогрессирования), по сравнению с применением в качестве поддерживающей терапии Авастина и плацебо. Данные результаты являются долгожданным известием для пациентов и их врачей, поскольку увеличение времени, в течение которого пациенты могут жить без прогрессирования их заболевания является ключевой задачей лечения рака лёгкого. У большинства больных рак лёгкого диагностируется на поздней стадии, и они умирают в течение 12 месяцев с момента постановки диагноза.
«ATLAS – это второе исследование, показавшее, что больные раком лёгкого, ежедневно принимавшие по таблетке Тарцевы после окончания терапии первой линии, прожили дольше без прогрессирования заболевания» - заявил Уильям Бёрнс (William M. Burns), глава подразделения Фарма компании Рош. «Эти результаты дополняют данные, которые в настоящее время доступны для Авастина в качестве терапии первой линии и Тарцевы в качестве терапии второй линии. Они дают новую возможность помочь этим пациентам увеличить время, в течение которого больные смогут прожить без прогрессирования их заболевания».
Предварительный анализ безопасности показал, что данные по нежелательным явлениям соответствуют результатам, полученным в ходе предшествующих исследований Авастина и Тарцевы, а также данным исследований, в которых оценивалась комбинация этих препаратов. Новых нежелательных явлений зарегистрировано не было.
Авастин и Тарцева уже зарегистрированы в США и Европе для лечения больных распространенным раком лёгкого. Доказано, что использование Авастина в первой линии терапии приводит к максимально возможному на настоящее время увеличению общей выживаемости больных, а Тарцева хорошо зарекомендовала себя в качестве терапии второй и третьей линии больных распространенным раком лёгкого. Кроме того, в исследовании SATURN было показано, что применение Тарцевы в качестве поддерживающей терапии первой линии – сразу после химиотерапии препаратами платины – существенно продлевает время, в течение которого пациенты с НМРЛ живут без прогрессирования заболевания по сравнению с плацебо.
Данные исследования ATLAS будут представлены на предстоящей медицинской конференции. Рош планирует обсудить эти данные с регуляторными органами с целью определить последующие шаги.
Обисследовании ATLAS (AVF3671g)
ATLAS – международное многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование, в которое было включено 1157 пациентов с местно-распространенным, рецидивирующим или метастатическим НМРЛ. Первоначально пациенты получили терапию первой линии (четыре цикла Авастина в комбинации с различными режимами химиотерапии по выбору исследователей - карбоплатин/гемцитабин, карбоплатин/паклитаксел, карбоплатин/доцетаксел, цисплатин/винорельбин, цисплатин/доцетаксел или цисплатин/гемцитабин). Далее (при условии отсутствия прогрессирования заболевания и непереносимой токсичности) пациенты были рандомизированы (n=768) на группы для получения поддерживающей терапии Авастином в комбинации с Тарцевой или Авастином и плацебо до прогрессирования заболевания. Основным оцениваемым параметром эффективности была выживаемость без прогрессирования после химиотерапии, определяемая как отрезок времени от рандомизации до прогрессирования заболевания или до смерти во время лечения в рамках клинического исследования. Дополнительные цели включали оценку общей выживаемости, частоты нежелательных явлений и частоты серьёзных нежелательных явлений, а также частоты случаев прекращения лечения.
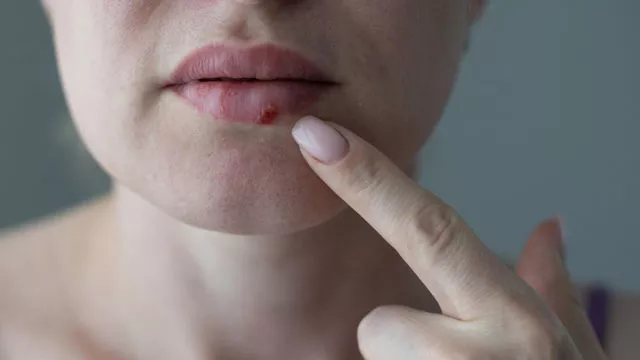 Здравоохранение
Снова герпес: почему он возвращается, и как с ним бороться
Здравоохранение
Снова герпес: почему он возвращается, и как с ним бороться
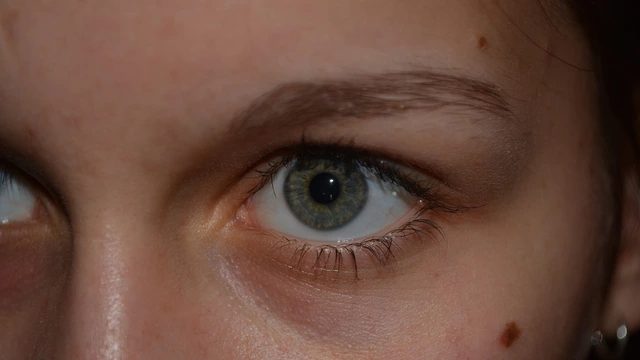 Здоровье
5 признаков меланомы: зачем зимой проверять родинки
Здоровье
5 признаков меланомы: зачем зимой проверять родинки







