Одобрен препарат, на 20% снижающий риск смерти от сердечной недостаточности
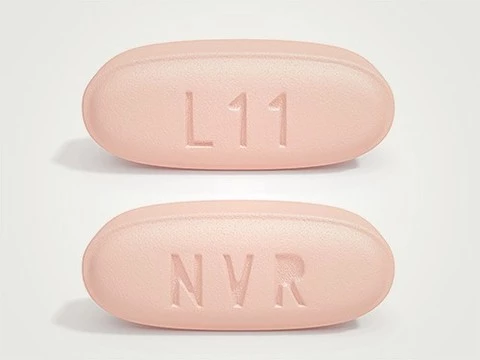
Управление США по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило к применению препарат LCZ696 (известный как Entresto) для лечения сердечной недостаточности. Сообщается, что препарат от компании Novartis снижает риск преждевременной смерти пациентов из этой категории на 20%.
«Это один тех прорывов, которые случаются раз в десять лет», — считает глава фармацевтического подразделения Novartis Девид Эпштейн (David Epstein). По оценкам экспертов, новый препарат сможет заменить стандартную терапию ингибиторами ангиотензин-превращающего фермента (иАПФ). В состав лекарства входит два компонента: валсартан и сакубитрил.
По подсчетам компании, стоимость лечения составит $ 12,5 в день, то есть около $ 4,5 тысяч в год. Согласно инструкции, ежедневно необходимо принимать по две таблетки LCZ696. Представители компании назвали установленную рыночную стоимость «действительно приемлемой». Ранее препарат вошел в рейтинг лекарств, продажи которых превысят 1 млрд в ближайшие четыре года. По мнению аналитиков Thomson Reuters, к 2019 году LCZ696 принесет компании Novartis около $3,7 млрд.
Министерство юстиции США направило в суд документы, согласно которым с фармацевтической компании Novartis планируется взыскать $3,35 млрд за подкуп врачей. Минюст утверждает, что в 2004-2013 годах компания платила откаты врачам за продвижение своих препаратов Exjade и Myfortic.
В клинических испытаниях препарата, подтверждающих его эффективность, приняли участие 8400 участников. Добровольцы из контрольной группы принимали плацебо, а участники, которые вошли в экспериментальные группы, принимали либо LCZ696, либо эналаприл — ингибитор АФП. При этом все добровольцы могли продолжать принимать другие лекарства, например, бета-блокаторы, если их врачи считали, что это необходимо.
Оказалось, что прием препарата от Novartis снижал риск смерти от сердечной недостаточности на 20%. По данным компании, более двух миллионов американцев смогут принимать препарат. К ним относятся пациенты, страдающие от сердечной недостаточности II- IV класса. FDA отмечает, что прием препарата вызывает развитие таких побочных эффектов, как понижение артериального давления, повышение уровня калия в крови, а также развитие почечной недостаточности.
The Food and Drug Administration on Tuesday approved a new heart failure drug from Novartis that has been shown to reduce death and hospitalizations from the condition. Excitement has been growing for the drug, known as Entresto, since the results of a large clinical trial were announced nearly a year ago showing a 20 percent reduction in the risk of death from cardiovascular causes or hospitalization for worsening heart failure.
The New York Times Здравоохранение
Снова герпес: почему он возвращается, и как с ним бороться
Здравоохранение
Снова герпес: почему он возвращается, и как с ним бороться
 Здоровье
5 признаков меланомы: зачем зимой проверять родинки
Здоровье
5 признаков меланомы: зачем зимой проверять родинки







