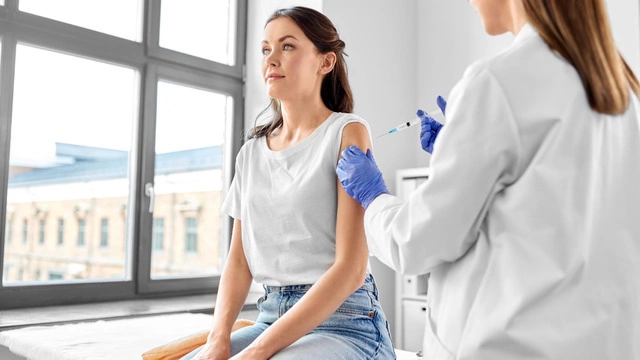
Реализация партии «Авастина» приостановлена
Федеральная служба по надзору в сфере здравоохранения объявила о приостановке реализации партии «Авастина», лекарственного препарата производства фармацевтической фирмы Roche. Это произошло после того, как у пациентов НИИ глазных болезней имени Гельмгольца, которым были сделаны инъекции препарата, развились серьезные осложнения, приведшие к потере зрения.
По факту потери пациентами зрения Следственный комитет РФ возбудил уголовное дело по статье «оказание услуг, не отвечающих требованиям безопасности» (ч. 1 ст. 238 УК РФ).
ЧП в институте глазных болезней им. Гельмгольца, где после укола Авастина ослепли 11 человек.
Представители компании-производителя подчеркнули, что лекарство не предназначено для использования в офтальмологии и по инструкции должно назначаться онкологическим больным. Однако Марина Харлампиди, главный врач НИИ имени Гельмгольца отметила, что «данный препарат рекомендован Всемирной Организацией Здравоохранения для лечения данных заболеваний, – подчеркнула Марина Харлампиди, – эксперты ВОЗ признали, что польза препарата превышает риск развития побочных эффектов при введении препарата внутрь глаза».
На сайте Росздравнадзора опубликовано сообщение, из которого следует, что медицинские организации должны проверить наличие у себя лекарства одной из серий. Территориальные органы Росздравназдора должны «обеспечить контроль за выявлением и изъятием» препаратов из обращения.
Известно, что пациенты, у которых развились осложнения после инъекции, прооперированы и чувствуют себя удовлетворительно. «Мы можем говорить о положительной динамике, состояние глаз значительно улучшилось», – сообщила Марина Харлампиди. Представители института отметили, что все больные уже страдали тяжелыми прогрессирующими заболеваниями, которые приводили к ухудшению зрения и даже слепоте. Специалисты подчеркнули, что проводимая терапия была необходима пациентам. Отметим, что использование препарата off-label, то есть по показаниям, не указанным в инструкции – распространенная мировая практика.
 Врачи говорят
Педиатр Алексей Бессмертный: «Пробовать снег и сосульки — это нормально для ребенка»
Врачи говорят
Педиатр Алексей Бессмертный: «Пробовать снег и сосульки — это нормально для ребенка»
 Врачи говорят
Почему болят колени: 6 вопросов врачу-ортопеду
Врачи говорят
Почему болят колени: 6 вопросов врачу-ортопеду