FDA будет публиковать больше данных о новых лекарствах
Управление по контролю за продуктами и лекарствами США (FDA) обещает сделать свою работу более открытой для общественности. Об этом заявила во вторник глава американского надзорного ведомства Маргарет Гамбург (Margaret Hamburg). С этой целью в аппарате управления создана специальная рабочая группа, которая готова принимать конструктивные предложения как от сотрудников Управления, так и от независимых экспертов и рядовых граждан США.
По словам М. Гамбург, FDA стремиться сделать свои решения максимально понятными для граждан США и повысить уровень доверия населения к надзорному органу.
Рабочую группу возглавит первый заместитель руководителя FDA Джошуа Шапфштайн (Joshua Sharfstein), результаты работы группы будут представлены в течение полугода.
Непрозрачность деятельности FDA вызывает критику экспертов и недовольство простых американцев. В частности, Управление как правило не раскрывает информацию о ходе клинических испытаний и процессе регистрации новых лекарственных средств, об отказе в регистрации препаратов, об отзыве продуктов и лекарств, а также о причинах таких решений.
Такое положение отчасти объясняется особенностями американского законодательства, жестко ограничивающего право федеральных ведомств на публикацию данных, которые могут составлять коммерческую тайну. Вместе с тем, в ряде случаев отсутствие подробной информации о безопасности лекарств и продукции медицинского назначения создает угрозу для здоровья потребителей.
 Здравоохранение
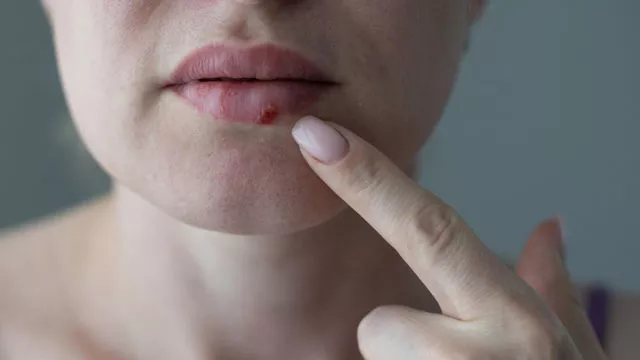
Снова герпес: почему он возвращается, и как с ним бороться
Здравоохранение
Снова герпес: почему он возвращается, и как с ним бороться
 Здоровье
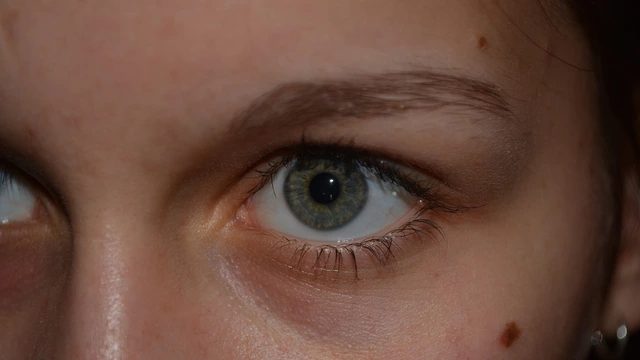
5 признаков меланомы: зачем зимой проверять родинки
Здоровье
5 признаков меланомы: зачем зимой проверять родинки







