Хозяин жизни и смерти
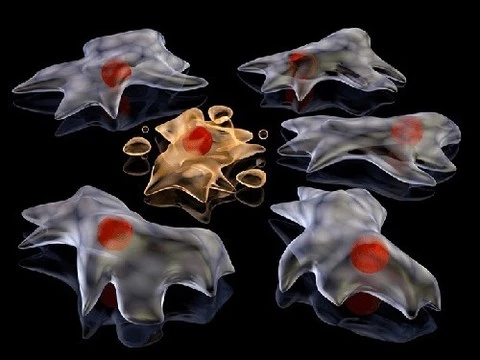
Второго июля 1992 года вышла статья иммунолога Дэвида Лейна о роли белка p53 как «стража генома». Пари в пивной привело к открытию клеточного правительства. Если ДНК несет в себе гены, то p53 включает их и выключает по своему усмотрению. Смерть от рака, диабета, инсульта — в руках этого вещества, которое правит клеткой и вершит её судьбу. Врачам будущего предстоит научиться влиять на его решения.
О пользе прививок
Природа рака открылась благодаря громадному антипрививочному скандалу. В 1960 году американцы всерьёз задумались о переходе с убитой вакцины от полиомиелита на живую, которую создал в Цинцинатти Алберт Сэбин, а производил в Подмосковье его друг Михаил Чумаков. Массовые вакцинации в СССР показали гораздо лучший результат, чем прививки убитой вакциной Солка в Соединённых Штатах. Культуру Сэбина на обезьяньих почках стали внимательно изучать и обнаружили, что она загрязнена другим вирусом, которым болеют макаки-резусы. Новый вирус получил название SV40, что означает всего лишь «обезьяний вирус №40».
«Обезьяний вирус» SV40 (вверху) и его большой T-антиген (внизу). Фото: Shutterstock/FOTODOM/ SUJITRA CHAOWDEE Графика: Phoebus87, Astrojan/Wikipedia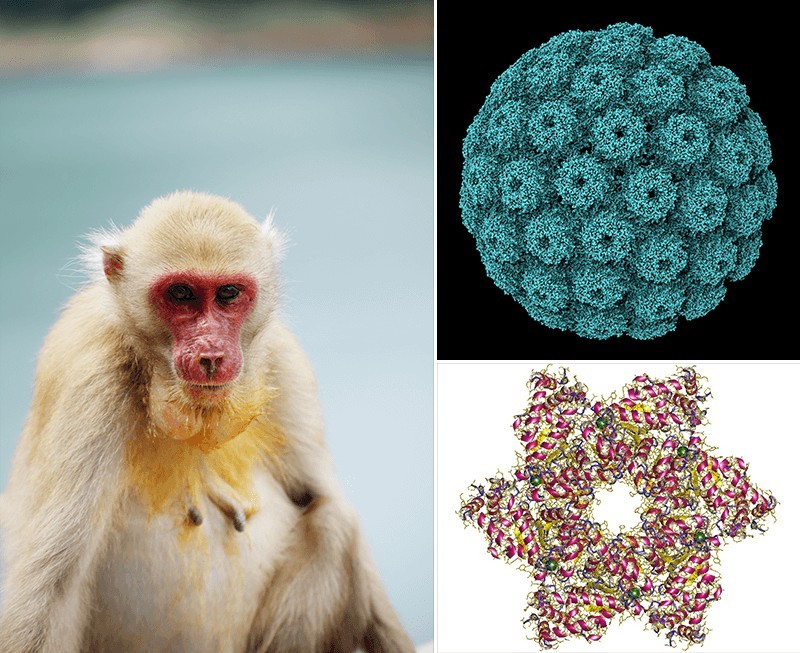
На всякий случай производители вакцин заменили резусов приматами других видов, свободных от SV40. Патогенность его для человека неизвестна, зато к 1962-му выяснили, что он вызывает рак у хомячков. Досаднее всего было то, что вакцина Солка, которую с 1955 года успели ввести десяткам миллионов детей, также содержала SV40: Солк убивал вирус полиомиелита формалином, который на SV40 не действует.
Трудно сказать, насколько этот просчёт фатален. Не исключено, что гибель от рака некоторых сорокалетних американцев, которые в 50-х были детьми, могла быть связана с SV40. Важно, что урок усвоен полвека назад и опасности для нынешних детей не существует. Тем не менее, история с обезьяньим вирусом остаётся любимым пугалом антипрививочников. На любом их форуме вы обязательно её найдёте с рефреном, что учёные «могут повторить» и мало ли чего от них ещё можно ждать.
На самом деле в лице SV40 всем нам улыбнулась удача: вдоль и поперёк изученный онкогенный вирус, вызывающий злокачественные опухоли у подопытных животных, — лучшая модель для отработки «прививки от рака», то есть вакцины против онкогенных вирусов. В 70-е годы на эту тематику бросили миллионы долларов и привлекли тысячи учёных, среди который был юный Дэвид Лейн.
Дэвид Лейн (слева) в 1979 году в США, во время стажировки у открывателя ДНК Френсиса Крика. Фото из статьи Николая Желева к юбилею Дэвида Лейна, опубликованной в журнале Biodiscovery 1 июля 2012.
Родился он в 1952 году в католической британской семье. Католики в Англии — обособленная каста, некогда гонимая. Отец Лейна считал, что Дэвид зря выбрал профессию биолога: учёный-католик мог не найти в Англии работы. Ведущие университеты — Оксфорд и Кембридж — вотчина протестантов. Лейна ждал Лондонский университет, по традиции прибежище квакеров, католиков, марксистов и евреев. В те времена выпускников этого вуза воспринимали скептически.
Дэвид знал это, но иной карьеры не желал. В школе он учился плохо. Отчаявшись заинтересовать ребёнка хоть чем-нибудь, родители на десятый день рождения подарили ему дешёвый пластиковый микроскоп. Не то чтобы мальчик взялся за книги и стал мечтать о науке, но сама возможность видеть то, чего не видят одноклассники, его радовала. Он решил стать иммунологом, чтобы смотреть в микроскоп и дальше.
Мало чисел
Едва Лэйн поступил в университет, его отец скоропостижно скончался от рака прямой кишки. Ощущение полной беспомощности перед страшной болезнью, охватившее тогда всю семью, определило выбор специальности Дэвида: онкоиммунология. Чтобы гарантированно получить место исследователя вопреки религиозным предубеждениям, пришлось освоить работу с изотопами. К началу 70-х учёные вполне изведали прелести облучения, среди молодых развилась радиофобия, так что конкурентов почти не было.
Как специалист по меченым радиоактивным иодом белкам, Лейн был привлечён к серьёзной работе над SV40 в обход многих старших товарищей, ещё до защиты диссертации. В Имперском фонде изучения рака (ныне фонд Cancer Research UK) занимались антигеном T — активной частью вируса SV40, ответственной за онкогенный эффект. Антитела, которые вырабатывает организм, должны быть нацелены на этот антиген. Но обнаружились ещё антитела на какой-то белок, образующийся в самой клетке при введении антигена. Масса молекулы этого белка была в 53 тысячи раз больше массы протона, поэтому в конце концов его назвали p53.
«Страж генома» белок p53 обследует ДНК своей клетки: двойная спираль охвачена агрегатом из 4 молекул этого белка. Графика: Shutterstock/FOTODOM/ibreakstock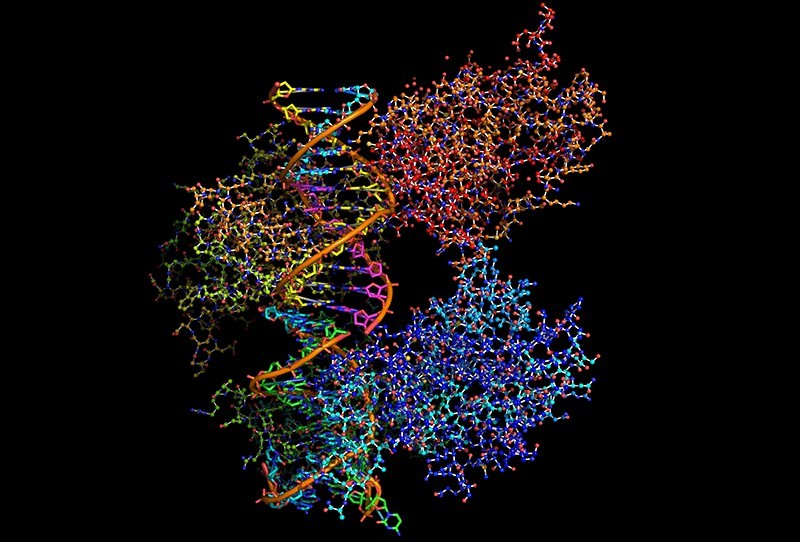
В норме никакого p53 в клетке не обнаруживалось, но возникал он явно не из вируса. Лейн решил проверить, не связано ли его появление с раком вообще. И в тканях мышей, больных полиомой, вызванной другим вирусом, тоже нашёлся p53. Осенью 1978 года Лейн и его сотрудник Лайонел Кроуфорд отослали в «Nature» статью об этом открытии, содержавшую три числа и нахальное предположение, что p53 «регулирует определённые клеточные функции». Рецензенты статью завернули по трем причинам: 1) это никому не интересно 2) этот результат получили другие, и 3) мало чисел.
Авторы статьи быстро произвели биофизические измерения, так что чисел стало 4, и в 1979-м статья всё же вышла. К тому времени p53 выделили сотрудники ещё трёх лабораторий, среди них в Принстоне — Арнольд Левин, в будущем один из ключевых исследователей этого белка.
Пари в пивной
Поскольку p53 был первым известным специфическим белком, непременно появляющимся в злокачественных клетках, на него набросились учёные всего мира. В 1982 году сын Михаила Чумакова Пётр в Институте молекулярной биологии клонировал ген, отвечающий за производство этого белка; p53 стал доступен для исследований. Следующие 10 лет предположения насчёт его роли напоминали притчу о слепцах, которые ощупывали слона. Одни сообщали, что этот белок и есть причина рака, потому что его всегда находят в метастазах. Другие заметили в метастазах только белок-мутант. Так обстояло, в частности, с раком прямой кишки: полип перерождается в злокачественную опухоль в присутствии мутировавшего p53. Третьи сообщали, что нормальный (биологи говорят «дикий») p53 напротив, подавляет развитие опухолей.
Лейн наблюдал дискуссию со стороны, поскольку был занят написанием методического руководства по выделению антител. Книга вышла в 1988 году, стала мировым учёным бестселлером — продали 40 тысяч экземпляров. Она сделала автору имя в науке. Когда раковый фонд решил устроить лабораторию при университете шотландского города Данди, Лейна командировали руководить этим подразделением.
Решили заняться p53, но никак не могли выработать программу. Требовалась общая рабочая версия, а у каждого из сотрудников она была своя. Спор занял целый день и продолжился в пабе. Лейн отстаивал гипотезу своей юности: p53 не союзник онковируса, а командир генома, и выдвигается на передовую при опасности возникновения рака.
Проверить это очень просто. Известно, что рак кожи вызывается ультрафиолетовым излучением. Надо поместить подопытное животное в солярий, потом взять образец кожи на анализ и отследить концентрацию p53. Вот только с подопытными животными у новой лаборатории были сложности, особенно без утвержденной программы.
Сотрудник по имени Питер Холл взялся провести эксперимент на себе. Немедленно заключили пари на пиво и приступили к делу. Холл закатал рукав, получил под кварцевой лампой дозу ультрафиолета, соответствующую 20 минутам пребывания на пляже Корфу. Затем в течение двух недель Лейн срезал для анализа кожу с облучённой части руки. Всего потребовалось девять разрезов. Холл плохо переносил биопсию, каждый шрам у него воспалялся. Но гипотеза подтвердилась: p53 в больших количествах появляется в ответ на любое воздействие, чреватое повреждением генома.
Лейн направил в «Nature» сообщение об эксперименте. Белку p53 определялось место регулятора, дирижёра и генерального менеджера генома, который в случае опасной поломки останавливает клеточный цикл и включает гены синтеза белков, занимающихся ремонтом ДНК. Статья носила рабочее название «Два белка идут навстречу друг другу». Редактор забраковал заголовок как скучный.
Роль p53 как главного защитника генома выяснилась сравнением состояния контрольных мышей и так называемых «нокаутных», т.е. таких, у которых ген p53 отключён с рождения. В течение 6 месяцев со дня рождения все «нокауты» были больны лимфомами, за 9 месяцев никого из них не осталось в живых. Этот факт Лейн анализировал в своей исторической статье 1992 года. Рисунок: Shutterstock/FOTODOM/Dmitriy Trubin
Тогда-то Лейну и пригодилось религиозное воспитание. В клетке p53 борется за традиционные ценности. Молекула ДНК для него святыня, на которую нельзя посягать. По аналогии со «стражем веры» белок p53 можно назвать «стражем генома» («The Guardian of the Genome»). И вот это уже подходило для статьи, опубликованной 2 июля 1992 года.
Страж, правитель, судья и палач
Удачное название позволило быстро осмыслить происходящее. Достаточно применить эволюционную теорию Дарвина. Геном каждой клетки предписывает ей определённую роль в организме. Пока у всех клеток ткани одинаковые гены, все работают по общей программе, делают общее дело. Но если геном станет различаться, клетки начинают соревноваться в полном соответствии с теорией естественного отбора. Борьбу за существование выигрывает тот, кто быстрее делится и оттягивает на себя ограниченные ресурсы. Разница между богатыми и бедными растет, богатые наживаются за счет общества, пока бедные не протянут ноги. Организм утрачивает единство и гибнет. Вот что такое рак.
Для поддержания порядка в каждой клетке существует правительство, оно же верховный суд. Эту функцию исполняет белок p53. Он постоянно обследует ДНК и не позволяет её копировать, если находит изменение. Когда же геном нарушен так сильно, что восстановлению не подлежит, клетка либо приговаривается к преждевременному старению, либо получает приказ совершить самоубийство. Белок p53 запускает производство ферментов-убийц и сам участвует в казни. Обломки разрушенной клетки — апоптозные тельца — поедают макрофаги.
Это передний рубеж войны с раком, подстерегающим нас каждую минуту. Как только прояснилась роль p53, стало понятно, почему работает лучевая терапия рака и химиотерапия. От них раковые клетки получают такие повреждения, что «страж генома» отдаёт приказ покончить с собой.
Когда правительство имеет такую власть, необходима оппозиция. Она была открыта в том же 1992 году. Это весьма скромных размеров белок под названием Mdm2. Правитель p53 сам запускает процесс создания этой оппозиции — аппарат самоуничтожения. Если всё в порядке, через 20 минут молекулы белков p53 и Mdm2 соединяются, и этот агрегат отправляется в протеазу — нечто среднее между мясорубкой для белков и компостной кучей. Но если при обследовании ДНК правитель находит повреждение, его молекула соединяется с остатком фосфорной кислоты так, что оппозиция не может к нему подобраться и утащить в мясорубку. Так директор генома получает чрезвычайные полномочия. Белка p53 становится всё больше, пока не разберутся с поломкой. Если сигналы о нарушении генома смолкнут, весь p53 списывается, его концентрация падает почти до нуля. Это и наблюдал Дэвид Лейн в коже своего ассистента.
Строение «оппозиционного» белка Mdm2. Графика: Gonn/Wikipedia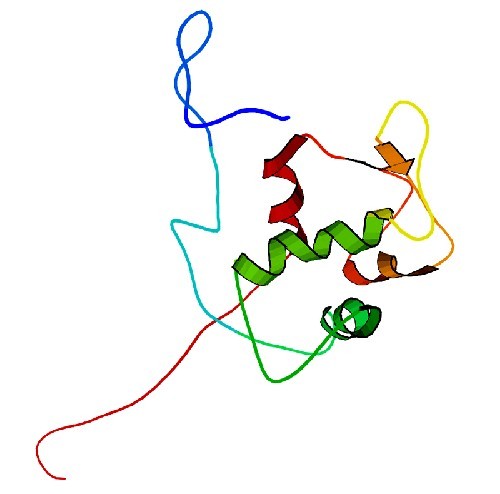
Когда правительство становится преступным
Однако p53 не бесплотный дух, его производит вполне материальный ген, который сам уязвим для излучения и подвержен мутации. Продукт изменённого гена часто не думает отдавать приказ о самоубийстве ненормальной клетки. Мутант пресекает деятельность оппозиции и велит делиться, экспортировать мутацию, и также производить ферменты, которые тянут капилляр от ближайшего кровеносного сосуда. Потомство больной клетки размножается, захватывая всё новые каналы снабжения, и образует опухоль.
Мутанты вызывают до 70% всех злокачественных образований. Хорошая новость в том, что для каждого вида рака характерна своя мутация p53, которую можно установить и обнаруживать при рутинном анализе. Так, Лейн установил, замена какой конкретно аминокислоты в определённой точке молекулы «стража генома» приводит к развитию рака прямой кишки, от которого погиб его отец. Узнали в Данди и адрес роковой подмены аминокислоты под воздействием бензпирена в организме курильщика, у которого развился рак лёгких. Пришлось даже объясняться с юристами табачных компаний, очень просившими Лейна «не заявлять об этом столь определённо».
Раковый ангиогенез: клетка опухоли вырабатывает фактор роста VEGF, активизируя создание питающего её кровеносного сосуда. Сосуды, охватывающие опухоль подобно клешням рака, дали онкологическим заболеваниям название «рак». Белок p53 здоровых клеток в борьбе с онкопатологией подавляет избыток фактора роста VEGF. Графика: Shutterstock/FOTODOM/ellepigrafica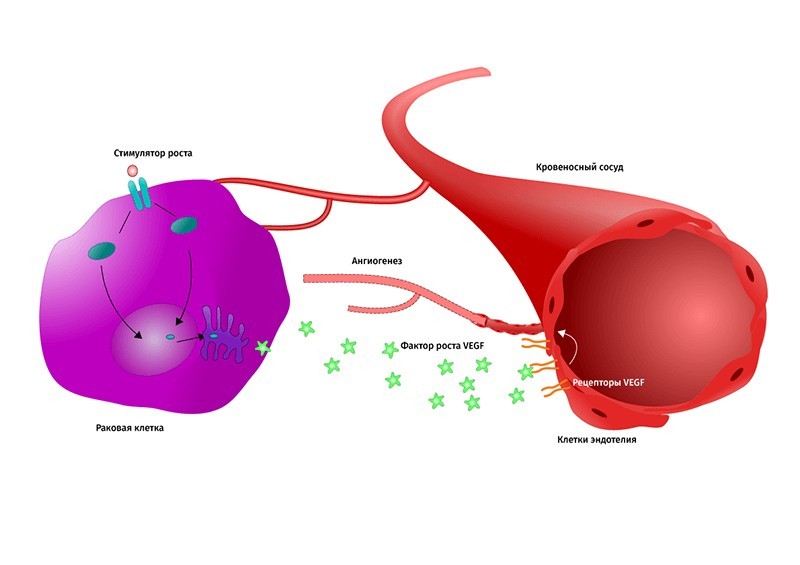
Но от такого предложения можно было отказаться, потому что запугивать учёных уже поздно. Белком p53 оперативно занялись сотни лабораторий по всему миру. В первую очередь искали средства от рака.
Самая простая идея — помочь «стражу генома» в случаях, когда мутации p53 нет: таких раковых больных более 11 миллионов. Например, концентрацию правящего белка можно поднять, задавив оппозицию. В 2004 году Любомир Василев сумел ингибировать белок Mdm2 в организме мышей и свести на нет опухоли у подопытных животных. Летом 2010 года в 4 городах Франции компания «Хоффманн-Ля Рош» начала клинические испытания на больных с липосаркомой.
Почему мы умираем
Результаты пока не опубликованы, но в частных беседах испытатели не высказывают энтузиазма. Вообще в геноме человека оппозиция «стражу генома» нужна. Она под ручку провожает белок p53 в митохондрию, откуда правитель генома запускает процесс самоубийства раковой клетки. Без Mdm2 «страж генома» выбирает роль «правительства профессионалов, которое должно работать при любом режиме» и помогает копированию изменённой ДНК, позволяя раковым клеткам если не размножиться, то по крайней мере воспроизвести свою численность.
С другой стороны, если отключить p53 вовсе и передать власть оппозиции, клетка обнуляет все настройки и превращается в стволовую. Арнольд Левин уже сказал, что p53 — страж не только генома, но и эпигенома. Он придаёт клетке индивидуальность, подобно тому как во всём мире простые люди похожи друг на друга, а правящие классы имеют разные идеи и воспитание, придавая своим странам национальную физиономию.
Хотя опыт с ингибитором нельзя назвать удачным, он продвинул вперёд диагностику. Каждый день в теле среднего человека «страж генома» списывает 50 миллиардов неремонтопригодных клеток. При наличии опухоли несколько десятков миллионов из них — раковые. Материал с мутациями поступает в кровь, и по анализу ДНК можно сказать, остались ли ещё злокачественные образования. Это очень важно знать после операции — решая, назначать ли химиотерапию, которая стоит до 100 тысяч евро и может причинить немалый вред. Лейн по этому поводу полон оптимизма: можно облегчить и удешевить диагностику рака, поглощающую по 40 миллиардов долларов в год.
Дэвид Лейн в год своего 60-летия. Шотландия, округ Файф, город Или. Фото из статьи Николая Желева к юбилею Дэвида Лейна, опубликованной в журнале Biodiscovery 1 июля 2012.
Чтобы найти способ манипулировать клеточным правительством, обратились к его истории. Откуда вообще взялся этот белок p53? Ему уже миллиард лет, он в тысячу раз старше человечества. За это время сделал большую карьеру. Возник он ещё у беспозвоночных. Начинал, так сказать, простым слесарем: опознавал повреждения ДНК и собственноручно их залечивал. Когда наши предки вышли на сушу из океана, обзавёлся двумя племянниками — p63 и p73. Они дублируют его функции и по-хорошему конкурируют с дядей.
По ходу эволюции p53 уже не каждую поломку чинил сам, а научился включать гены, вызывающие специально приспособленный под конкретную задачу фермент. Хотя «страж генома» — это такой директор завода, который в критической ситуации сам встаёт к станку, основная его функция — сбор информации. Белок p53 реагирует на тысячи сигналов ото всех систем клетки и распоряжается генами, ответственными за всевозможные процессы. Свой завод он «взрывает, чтоб не достался врагу» только при самой серьёзной опасности, а в мирное время его задача — руководить производством.
Как это бывает с руководителями, каждый имеет свой характер. Порядка 30 тысяч лет назад человеческий род разделился на две части: в одной «страж генома» более бдителен и чаще отдаёт решительные приказы. У таких людей вероятность заболеть раком меньше, но они редко доживают до 75 лет, потому что их клетки чаще обновляются, быстрее стареют.
Флуоресцирующие фибробласты – клетки лёгких человека – под микроскопом. Для профилактики рака лёгких (в частности, у курильщиков) белок p53 при сбоях в геноме этих клеток индуцирует их ускоренное старение. Фото: Shutterstock/FOTODOM/Damian Ryszawy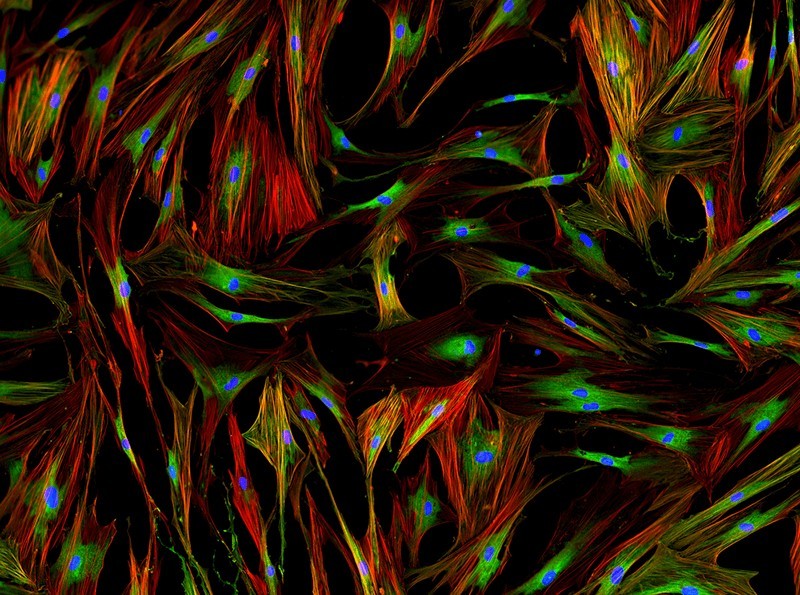
Бдительность не всегда хороша. Смерть от инсульта представляет собой массовое проявление бдительности со стороны «стражей генома». При нарушении снабжения клеток кислородом p53 принимает решение о несовместимости гипоксии с жизнью. Если найти способ притупить эту бдительность, можно было бы сократить потери.
Мышь против суперкомпьютера
Эксперименты на мышах тут не во всём помогут. У грызунов белок p53 играет несколько иную роль. Да и среди людей он сильно различается. Разные формы p53 у мужчин и женщин (отсюда неодинаковая предрасположенность двух полов к разным видам рака), у русских и китайцев (например, китайские женщины подвержены раку носоглотки в 80 раз сильнее, чем русские).
Наконец, рак — удобная для изучения болезнь: заметные мутации, громадные количества p53, массовые жертвоприношения. А чем занят директор генома при не столь смертельных патологиях? Что предпринимает он при аутизме, диабете, ожирении? Мыши ответ не дадут, эксперименты на людях неэтичны, манипуляции с геномом пациента незаконны. Даже если какому-нибудь правительству придёт в голову идея пустить часть населения на опыты, с p53 это не поможет. Он забрал себе слишком большую власть.
Всего лишь за четверть века число работ об этом белке перевалило за 50 тысяч. Мы знаем две тысячи генов, которые p53 включает и выключает; по расчётам биоинформатиков их вдвое больше. Пётр Чумаков говорит, что уходят последние годы, когда один человек может усвоить все знания о белке p53. Далее держать всё в уме сумеет лишь компьютер, а нам останется строить цифровые симуляции. Поначалу, видимо, не слишком удачные: объект изучения сам представляет собой биологический компьютер. Который оперирует на малопонятном языке, постоянно подвергается вирусным атакам, виснет и ошибается, норовя то захватить мировое господство, то закрыться от мира и внутри своих границ передушить всё живое.
Шесть принципов придумывания хорошей научной идеи, высказанные Дэвидом Лейном в ходе выступления 3 июня 2017 года. Графика: МедМедиа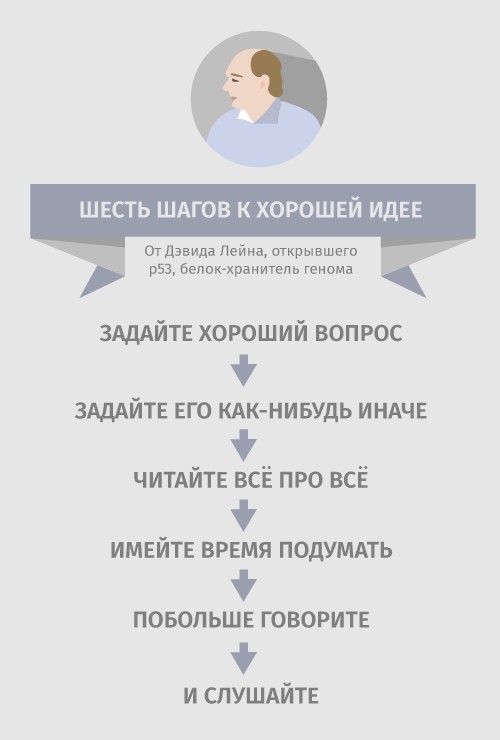
Подписи к иллюстрациям:
Источники и дополнительная литература:
— Lane DP, Crawford LV. T antigen is bound to a host protein in SV40-transformed cells.
— Профиль Лейна как главного учёного и директора лаборатории p53 на портале сингапурского Агентства науки, технологии и исследований A*STAR
— Любомир Василев о разработанном исследователями «Рош» ингибиторе Mdm2, 03.02.2004
— Результаты клинических испытаний ингибитора Mdm2 в 2010 году
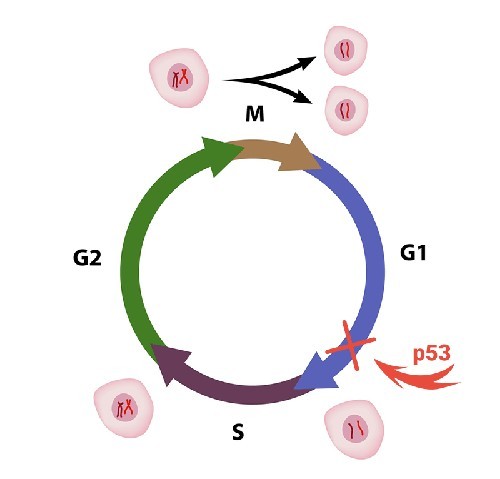
Вмешательство белка p53 в клеточный цикл. «Страж генома» проверяет ДНК в конце первой фазы роста, перед её репликацией. Если обнаруживаются повреждения, рост останавливается, геном «ставится на ремонт». Итогом может быть запуск или списание всей клетки. Графика: Shutterstock/FOTODOM/ Alila Medical Media
Видеофрагменты
Выступления Дэвида Лейна:
— Лекция Дэвида Лейна о роли белка p53 в развитии рака и новых средствах стимуляции работы его нормальной конформации, а также защиты клеток, где ген p53 не мутировал, при химиотерапии, 10.10.2012
— Дэвид Лейн о клинических испытаниях на больных лейкемией ингибитора взаимодействия p53 с факторами его подавления, 07.03.2017
— Дэвид Лейн о будущем прецизионной терапии и об открытой в 2015 году жидкостной биопсии, 19.04.2017
— Дэвид Лейн с рассказом о себе и своих взглядах на будущее биологии и медицины, 03.06.2017
— Анимация, выполненная Walter Jahn: структура белка p53 с показом ряда позиций определённых аминокислот, где замена приводит к определённым видам рака, 14.09.2014
— Учёные медицинского центра штата Теннесси о том, как именно p53поддерживает стабильность генома и предотвращает возникновение опухолей, на примере опухоли Вильмса, с анимацией, 2016
— Маттиас Дёббельштайн (Геттингенский университет) о неудаче клинических испытаний ингибитора Mdm2 и её возможных причинах, 29.06.2017
 Врачи говорят
Клещевые инфекции — чем опасен анаплазмоз? Объясняет врач
Врачи говорят
Клещевые инфекции — чем опасен анаплазмоз? Объясняет врач







