Клинические исследования: от фобий к разуму
28 июня в Совете Федерации состоялся круглый стол «Клинические исследования в обеспечении доступности и безопасности инновационных подходов в оказании медицинской помощи населению России». В работе круглого стола приняли участие представители СФ ФС РФ (Комитет по социальной политике); представители ГД РФ (Комитет по Охране здоровья, Комитет по образованию и науке); представители министерств и ведомств (МЗСР РФ, Росздравнадзора, Роспотребнадзора, ФСБ РФ, МВД РФ, ФТС РФ; МЭРТ РФ); представители науки (РАН РФ, РАМН РФ, Научно-исследовательские институты РФ); представители отраслевых профессиональных организаций (AIPM); представители фармацевтических компаний и медицинские специалисты.
Главными темами круглого стола стали вопросы по реализации мер организационного и правового регулирования проведения клинических исследований в России, зарубежный опыт и перспективы российского рынка лекарств, с точки зрения проведения клинисследований. Особое внимание было обращено на сегодняшнюю ситуацию в данной области и положение врачей, вовлеченных в процесс клинических исследований.
Основным препятствием формирования четкой системы организации клинических исследований остается отсутствие четкого регулирования и контроля со стороны государства, а также противоречия между законодательной и нормативной базами. Как прокомментировал Юрий Белоусов, Заведующий кафедрой клинической фармакологии Российского государственного медицинского университета им. Н.И. Пирогова, главный клинический фармаколог, член-корр. РАМН, д.м.н., профессор: «Клинические исследования в России сегодня регулируются только двумя федеральными законами, а существующие подзаконные акты не согласованы и не имеют законодательной силы».
В то время как все больше говорится о важности внедрения инновационных технологий в российской медицине и о необходимости предоставления высококачественной медицинской помощи населению России, налицо проблема правовой незащищенности врачей-исследователей и отсутствия их профессиональной и личной безопасности. «В настоящее время врач имеет право принимать самостоятельные решения на проведение клинических исследований, но вместе с этим не существует строгого разделения ответственности сторон», - сказал Александр Румянцев, директор Федерального научно-клинического центра детской гематологии, онкологии и иммунологии, главный детский гематолог Минздравсоцразвития РФ. Это говорит о том, что любой специалист может стать объектом преследования, как со стороны общественности, так и со стороны органов, исполняющих надзорные правоохранительные функции.
Одной из наиболее острых проблем остается обеспечение эффективности и безопасности лекарственной терапии пациентов-детей. Клинические исследования с участием детей начались в 2004 году, но пока единичны, и на их долю приходится всего 4,4% от общего объема. При этом 70% лекарств и вакцин, применяемых в российской педиатрии сегодня, назначаются как нелицензированные. Ситуация, по словам Лейлы Намазовой, заместителя директора ГУ Научного центра здоровья детей РАМН по науке, д.м.н., профессора, сложная: «Врачи и участники клинических исследований сталкиваются с некорректными и непрофессиональными действиями сотрудников региональных прокуратур, так называемых «региональных этических комитетов», департаментов здравоохранения. В результате, в 2006 году в одном из регионов международное клиническое исследование было решено прекратить».
Участники затронули этическую сторону клинических исследований. Сложившийся в обществе стереотип понимания клинических исследований как проведения опыта над человеком ошибочен. Именно поэтому понятие «клиническое исследование» и все, что с ними связано, должно быть правильно истолковано и разъяснено общественности. Как отметил в своем выступлении Виталий Омельяновский, руководитель Секции по социальным вопросам и охране здоровья населения России Экспертного совета Комитета СФ по социальной политике, профессор: «Происходящая подмена стереотипов в отношении клинических исследований может привести к дискредитации профессии врача. Необоснованные нападки на исследователей являются поводом для отдельного общественного обсуждения с привлечением институтов гражданского общества, и, может быть, при участии Общественной палаты».
Подводя итоги круглого стола, Валентина Петренко, Председатель Комитета СФ по социальной политике, еще раз обратила внимание участников заседания на наиболее важные аспекты в рамках прошедшего мероприятия и призвала стороны, ответственные за организацию и контроль над системой клинических исследований в России, к скорейшему разрешению обозначенных проблем: «Нам надо сделать так, чтобы ни у кого больше, как у государственных органов, так и общественных институтов, не было вопросов в отношении клинических исследований», - подчеркнула она.
 Здравоохранение
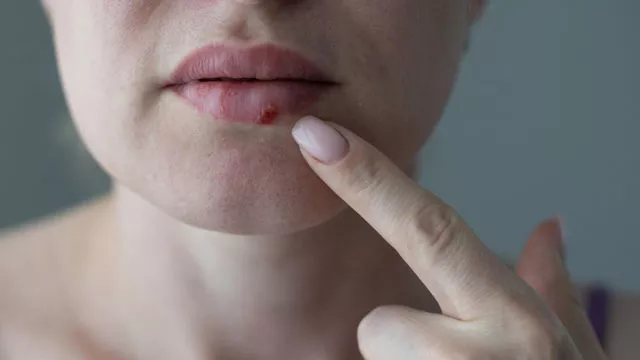
Снова герпес: почему он возвращается, и как с ним бороться
Здравоохранение
Снова герпес: почему он возвращается, и как с ним бороться
 Здоровье
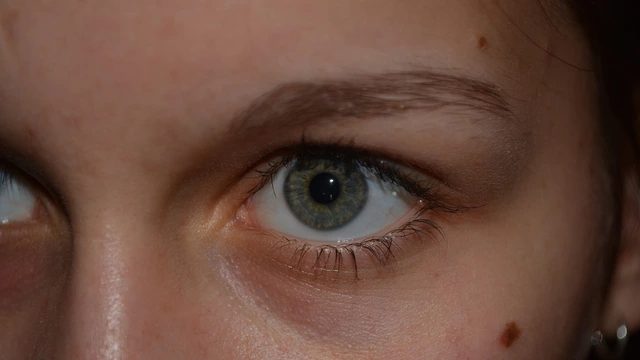
5 признаков меланомы: зачем зимой проверять родинки
Здоровье
5 признаков меланомы: зачем зимой проверять родинки







