Новейший препарат от лейкемии оказался смертельным
Клинические испытания новейших лекарственных препаратов – долгий и трудоемкий процесс. Чтобы создать новое средство, требуются годы исследований. Но даже вполне успешное прохождение первых стадий испытания новых препаратов не может застраховать от катастрофы.
В декабре прошлого года администрация по контролю за продуктами и лекарствами США (FDA) наложила запрет на клинические исследования перспективного экспериментального препарата от острого миелоидного лейкоза (AML) вадастуксимаба талирина (vadastuximab talirine). Согласно данным компании Seattle Genetics, владеющей правами на этот лекарственный препарат, в ходе клинических исследований у шести пациентов с острым миелолейкозом были обнаружены признаки гепатотоксичности, четверо участников клинических испытаний скончались.
Вадастуксимаба талирин (SGN-CD33A) — антитело, нагруженное лекарственным средством, специфичным к белку CD33. Данный белок экспрессируется на большинстве клеток острого амилоидного лейкоза. Препарат убивает раковые клетки, оставляя здоровые ткани неповрежденными. Исследования показали, что вещество действительно вызывает ремиссию у больных.
В марте запрет на дальнейшие испытания препарата был снят, и исследования на группе из 300 участников были продолжены. Однако на днях компания Seattle Genetics Inc заявила о том, что полностью прекращает исследование перспективного препарата на завершающей стадии испытаний из-за более высокой смертности у пациентов, принимающих препарат, по сравнению с контрольной группой, принимающей плацебо. Представители Seattle Genetics отказались раскрывать данные о количестве смертей, но при этом заявили, что все случаи смерти не были связаны с гепатотоксичностью препарата.

Фото: glassdoor.com
На разработку вадастуксимаба талирина, который ранее считался очень перспективным, были затрачены огромные средства и время. После известия о полной остановке испытаний акции компании резко упали в цене, а аналитики предсказали значительное сокращение выручки Seattle Genetics вплоть до 2021 года.
Известно, что большинство (порядка 90%) новейших лекарственных препаратов, которые достигают стадии клинических испытаний, эти испытания не проходят. Даже при достижении III стадии — а до нее добираются только лекарства, которые, очевидно, благополучно прошли отбор на предыдущих этапах — процент неудачи составляет 40%. Разработка лекарства — это уникальная комбинация крайне высокой законодательной нагрузки и очень высокого процента неудач, так что имеется соблазн сказать, что именно жесткое законодательство служит причиной провалов испытаний. Но это не так. Причина — в невероятной сложности процесса.
C 1979 по 2005 год стоимость разработки лекарственного препарата выросла с примерно 100 миллионов долларов до 0,8-1,2 миллиардов долларов.
За последнее десятилетие процедуры клинических исследований значительно усложнились. С 1999 по 2005 год количество анализов и обследований в рамках одного клинического исследования выросло с 96 до 158 (65%). При этом уровень набора пациентов (количество пациентов, удовлетворивших все более жёстким критериям отбора и включенных в исследование) упал с 75 до 59 %, а число пациентов, завершивших исследование, — снизилось с 69 до 48 % (30 %). Длительность клинических исследований выросла с 460 до 680 дней.
Почему так сложно?
Разработка лекарства сначала проходит доклинические исследования (на биологических моделях, "в чашке Петри"), затем испытание на лабораторных животных. Только при благополучном прохождении всех этапов (от мышей до приматов) дальнейшие исследования получают одобрение этического комитета и положительное решение уполномоченного органа здравоохранения той страны, где планируется проводить исследование. Только после этого можно переходить к клиническим испытаниям, которые подразделяются на три важнейших этапа.
- I этап. Препарат проходит первое испытание на человеке, которое в целом направлено на оценку переносимости лекарственного средства человеческим организмом, в нем принимает участие от нескольких десятков до примерно 100 человек — здоровых добровольцев. Если препарат высокотоксичный (для лечения онкологии, например), то в исследовании принимают участие пациенты с соответствующим заболеванием.
- II этап. Он предполагает участие в испытаниях уже нескольких сотен пациентов, страдающих определенным заболеванием, для лечения которого предназначен исследуемый препарат. Основной задачей II этапа клинических испытаний является выбор наиболее подходящей терапевтической дозы исследуемого препарата.
- III этап. Предрегистрационное исследование с участием уже нескольких тысяч пациентов разного возраста, и, как правило, из разных стран, для получения достоверных статистических данных, которые смогут подтвердить безопасность и эффективность лекарственного препарата.
Первый этап клинических исследований, безусловно, является самым опасным. Именно поэтому он проходит только в специализированных учреждениях, специально для этого оборудованных. В них участники эксперимента на любом этапе могут получить самую быструю и квалифицированную помощь, если что-то пойдет не так. Чаще всего такие исследования проводят в США, Голландии и Канаде. Во многих странах такие эксперименты запрещены законом. Так, в России наложен запрет на исследование зарубежных препаратов с участием здоровых добровольцев. Впрочем, этот запрет не распространяется на больных.
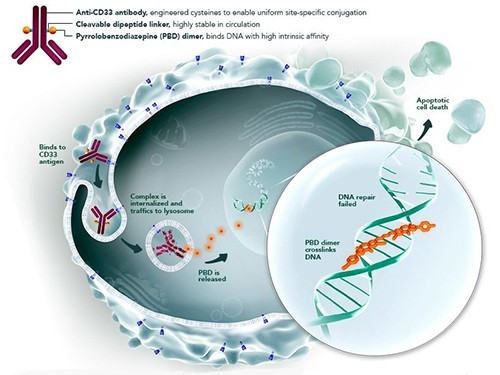
Схема действия вадастуксимаба талирина. Фото: seattlegenetics.com
В России рынок клинических исследований кардинально изменился в 2013 году: из преимущественно инновационного он превратился в дженериковый. Причиной этого изменения стал патентный обвал на мировом фармрынке и реакция иностранных производителей на закон «Об обращении лекарственных средств», согласно которому для регистрации иностранного лекарственного препарата в России необходимо представить результаты исследований с участием российских клинических центров.
В 2015 году вступил в силу ряд поправок в Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств». В частности, был переработан понятийный аппарат закона (особое внимание было обращено на референтные и орфанные лекарственные препараты), добавлены новые виды лекарственных препаратов, изменена процедура регистрации препаратов, порядок государственного регулирования цен на жизненно необходимые и важнейшие лекарственные препараты (ЖНВЛП), установлены параметры взаимозаменяемости и многое другое. Принятые поправки должны были упростить процесс разработки и испытаний новых препаратов, однако на деле процедура стала еще сложнее.
Однако такой механизм является абсолютно необходимым: большинство препаратов, дошедших до клинических испытаний, оказываются малоэффективными. Если систему контроля упросить (и, следовательно, удешевить), множество не до конца проверенных препаратов попадет в торговую сеть, что может вызвать непредсказуемые и часто необратимые последствия (как это уже однажды случилось с препаратом под названием «талидомид»). Именно поэтому дорогие и трудные клинические испытания для любого лекарственного препарата абсолютно необходимы, даже если в результате они становятся дороже. Это ведет за собой следующую проблему: если для распространенных заболеваний такие клинические испытания экономически оправданы, разработка лекарства для редких, орфанных заболеваний имеет очень низкие шансы. И это до сих пор остается неразрешимой этико-экономической проблемой.
 Врачи говорят
Клещевые инфекции — чем опасен анаплазмоз? Объясняет врач
Врачи говорят
Клещевые инфекции — чем опасен анаплазмоз? Объясняет врач







