СОБЫТИЯ: BiPar Sciences объявляет о новых достижениях в клинической разработке препарата BSI-201 для лечения метастатического трижды негативного рака молочной железы
Клиническое исследование III фаза препарата ВSI-201 началось в июле 2009 года для оценки его эффективности в комбинации с химиотерапией, проводимой у пациенток с метастатическим трижды негативным раком молочной железы (mTNBC), который определяют как опухоль, не экспрессирующую рецепторы эстрогена и прогестерона и без гиперэкспрессии HER2. BSI-201 – это новый исследуемый ингибитор поли (АДФ-рибозы) и полимеразы (PARP1) – фермента, восстанавливающего повреждения ДНК.
Решение приступить к исследованию III фазе в июле основывалось на обнадеживающих результатах, представленных Американскому обществу клинической онкологии (ASCO) 31 мая 2009 года. В клиническом исследовании II фазы женщины с метастатическим трижды негативным раком молочной железы (mTNBC) были рандомизированны в группы, принимавшие гемцитабин и карбоплатин (ГК) в комбинации с исследуемым препаратом BSI-201 или же только ГК. Обновленные данные II фазы, включая общую выживаемость, были представлены в пятницу, 11 декабря, в 17:30 по центральному поясному времени, на сессии 32-ого ежегодного симпозиума по раку молочной железы в Сан-Антонио (SABCS).
Добавление препарата BSI-201 к схеме ГК привело к увеличению медианы общей выживаемости с 7,7 месяцев до 12,2 месяцев. (НR=0,5, р=0,005). BSI-201 не увеличивал частоту или тяжесть побочных эффектов, связанных с проведением химиотерапии. Это не окончательный анализ данных исследования II фазы, скорее уточненный анализ общей выживаемости. Медиана выживаемости в группе, принимавшей BSI-201, все еще не достигнута, поэтому период для проведения анализа данных II фазы продлен с сентября по ноябрь.
«Уточненный анализ программы II фазы, включая данные об общей выживаемости, согласуется с положительными результатами, представленными ранее в этом году Американскому обществу клинической онкологии (ASCO)», - заявил Марк Клузель (Marc Cluzel), исполнительный вице-президент санофи-авентис по исследованиям и разработкам. «Мы очень воодушевлены быстрым набором пациенток в исследование III фазы. Надеемся, что полученные результаты приведут к разработке стратегии, которая поможет женщинам с метастатическим трижды негативным раком молочной железы».
Управление по контролю за продуктами питания и лекарственными средствами США (FDA) предоставляет препарату BSI-201 для лечения метастатического трижды негативного рака молочной железы (mTNBC) статус ускоренного рассмотрения. Как указывает Управление по контролю за продуктами питания и лекарственными средствами США (FDA), процесс быстрого рассмотрения направлен на ускорение проверки лекарственных препаратов, разрабатываемых для лечения серьезных заболеваний, обладающих потенциалом решения неудовлетворенных потребностей медицины.
Дополнительную информацию о клиническом исследовании III фазы препарата BSI-201 можно найти на сайтах: www.clinicaltrials.gov или www.biparsciences.com, или позвонив по телефону информационно-справочной службы BiPar Sciences: +1 866 668 2232.
О клиническом исследовании III фазы препарата BSI-201
Многоцентровое рандомизированное клиническое исследование III фазы разработано для оценки безопасности и эффективности препарата BSI-201 в комбинации с гемцитабином и карбоплатином (ГК) в лечении женщин с метастатическим трижды негативным раком молочной железы (mTNBC). Все 420 пациенток с метастатическим трижды негативным раком молочной железы (mTNBC), получивших ранее 0 -2 линии терапии по поводу метастатического процесса, будут рандомизированы для лечения по схеме ГК с BSI-201 или без него.
Основной задачей исследования III фазы является оценка улучшения выживаемости без прогрессирования и общей выживаемости. Дополнительная задача заключается в оценке объективного ответа и безопасности. Исследование охватывает 94 центра в США. Важно отметить, что это исследование перекрестное. Таким образом, всем пациенткам, включенным в это исследование, будет предоставлена потенциальная возможность пройти курс лечения препаратом BSI-201 (пациентки, рандомизированные в контрольную группу, могут пройти курс лечения препаратом BSI-201 после прогрессирования заболевания).
О препарате BSI-201
Препарат BSI-20, возможно, является лучшим в своей подгруппе, предназначенной для экспериментальной терапии, разработанной для ингибирования поли (АДФ-рибозы) и полимеразы (PARP1), фермента, восстанавливающего повреждения ДНК. Среди ингибиторов PARP в данной области, BSI-201 дальше всех других препаратов продвинулся по пути клинической разработки для лечения трижды негативного рака молочной железы (TNBC). В настоящее время изучается способность BSI-201 усиливать эффект вызываемого химиотерапией повреждения ДНК раковых клеток, когда проявлялась гиперактивность PARP. BSI-201 проходит испытания III фазы при лечении метастатического трижды негативного рака молочной железы (mTNBC), а также исследование II фазы при лечении пациенток с раком яичников, матки, мозга и легкого.
О трижды негативном раке молочной железы
При постановке диагноза рака молочной железы опухоль тестируется и классифицируется на основании наличия эстроген-, прогестерон- и HER2-рецепторов. Как правило, терапия рака молочной железы направлена на эти рецепторы. Однако в 15-20% случаев опухоль негативна по этим трем рецепторам, в связи с чем появился термин «трижды негативный рак молочной железы (TNBC)».
Трижды негативный рак молочной железы (TNBC) – крайне агрессивная форма опухоли, характеризующаяся высоким уровнем метастазирования и низкой выживаемостью по сравнению с другими подтипами рака молочной железы, в отношении которого не существует единого стандарта лечения.
О компании BiPar Sciences
BiPar Sciences – биофармацевтическая компания, осуществляющая разработку инновационных средств терапии направленного действия для удовлетворения срочных потребностей в лечении пациентов с онкологическими заболеваниями. Помимо препарата BSI-201, в стадии доклинической разработки находятся еще два препарата. BiPar Sciences является дочерней компанией санофи-авентис. Штаб-квартира компании находится в Южном Сан-Франциско, штат Калифорния. Дополнительную информацию можно получить по адресу: www.biparsciences.com.
О санофи-авентис
Cанофи-авентис, одна из ведущих мировых фармацевтических компаний, открывает, разрабатывает и распространяет терапевтические решения для улучшения жизни каждого человека. Санофи-авентис зарегистрирована на Парижской (EURONEXT: SAN) и Нью-Йоркской (NYSE: SNY) биржах.
Заявления прогностического характера
Этот пресс-релиз содержит заявления, которые являются заявлениями прогностического характера по смыслу Закона "О реформе судебных разбирательств по частным ценным бумагам" 1995 г., с учетом изменений и дополнений. Заявления прогностического характера - это заявления, которые не являются историческими фактами. К таким заявлениям относятся прогнозы и оценки относительно разработки и потенциала продукта, а также лежащие в их основе предположения, заявления о планах, целях, намерениях и ожиданиях в отношении будущих событий, операций, продуктов и услуг, а также заявления относительно будущей деятельности. Заявления прогностического характера обычно можно распознать по наличию слов "ожидает", "предполагает", "полагает", "намеревается", "оценивает", "планирует" и других подобных выражений. Несмотря на то, что руководство санофи-авентис полагает, что эти ожидания, содержащиеся в заявлениях прогностического характера, обоснованны, инвесторы должны учесть, что прогностическая информация и заявления зависят от различных рисков и неопределенностей, многие из которых трудно предсказать, и которые в основном не зависят от санофи-авентис. В этой связи реальные результаты и развитие событий могут значительно отличаться от тех, которые излагаются, подразумеваются или предполагаются в информации или заявлениях прогностического характера. К числу таких рисков и неопределенностей относятся, помимо прочего, неопределенности, связанные с исследованиями и разработками, будущими данными клинических исследований, включая постмаркетинговые исследования, решения регуляторных органов, таких как Управление по контролю за продуктами питания и лекарственными средствами США (FDA) или Европейское агентство по лекарственным препаратам (EMEA) в отношении возможности одобрения и соответствующей даты этого одобрения, заявки, которая может быть подана в отношении какого-либо препарата, устройства или биологического продукта, а также решения этих органов, касающиеся маркировки и других факторов, которые могут повлиять на наличие или коммерческий потенциал этих продуктов-кандидатов, отсутствие гарантии того, что в случае одобрения продукта последний будет иметь коммерческий успех, будущее утверждение и коммерческий успех терапевтических альтернатив, а также обсужденные или обозначенные в открытых документах, направленных санофи-авентис в Комиссию по ценным бумагам США (SEC) и Департамент финансовых рынков Франции (AMF), в том числе перечисленные в разделах "Факторы риска" и "Предостережение относительно заявлений прогностического характера" в Ежегодном отчете санофи-авентис по форме 20-F за год, завершившийся 31 декабря 2008 г. За исключением случаев, предусмотренных применимыми законами, санофи-авентис не берет на себя обязательств предоставлять новые варианты или пересматривать любые заявления или информацию прогностического характера.![]()
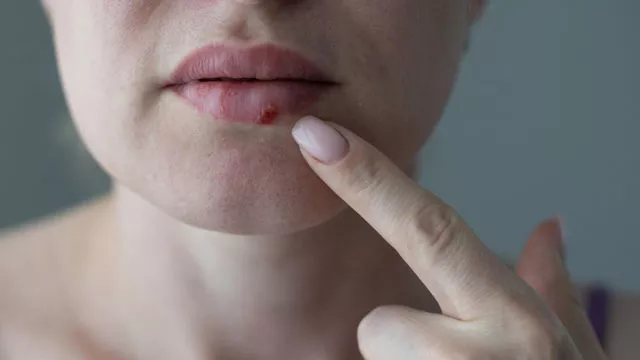 Здравоохранение
Снова герпес: почему он возвращается, и как с ним бороться
Здравоохранение
Снова герпес: почему он возвращается, и как с ним бороться
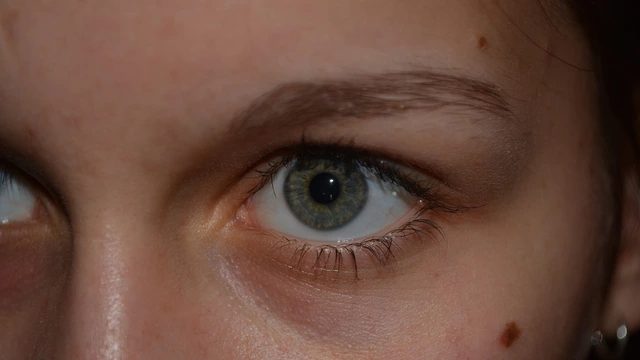 Здоровье
5 признаков меланомы: зачем зимой проверять родинки
Здоровье
5 признаков меланомы: зачем зимой проверять родинки







