Аутоиммунные болезни: гены и их регуляция
Как и для большинства других заболеваний, некоторые особенности ДНК могут влиять на предрасположенность к развитию аутоиммунных болезней.
В последнее время для поиска связи между отдельными изменениями в генах и фенотипическим их проявлением (например, болезнью) часто применяют методику полногеномного поиска ассоциаций — GWAS, в которой сравниваются геномы больных и здоровых людей. Эта техника позволила ученым выявить больше генов, чья вариативность может привести к атаке иммунной системы на свой организм, и уточнить механизмы патологий. Таким способом можно обнаружить даже минимальное отличие: например, в один нуклеотид.
Есть и практическое применение новых данных: выявляется больше мишеней для потенциальных терапевтических разработок. Кроме того, это поможет стратифицировать пациентов с одной болезнью — разнести их по разным группам по серьезности и клиническим проявлениям, ведь у разных людей течение заболевания отличается. Например, при ревматоидном артрите важны возраст человека на момент начала болезни, число пораженных суставов, и внесуставные осложнения появляются не у всех.
Помимо генетической предрасположенности, ученые говорят о важности эпигенетики. Иными словами, свой вклад вносит регуляция экспрессии генов, ведь помимо состава самой цепочки ДНК роль играет и то, «работает» ген в этот момент или нет. Из-за образа жизни и экологических факторов эпигенетическая регуляция меняется в течение жизни.
Генетика
Одни из важнейших молекул для иммунной системы — главный комплекс гистосовместимости (МНС), находящийся на поверхности клетки. Они бывают нескольких разновидностей. МНС класса I экспрессируется почти во всех клетках, и в его состав входят части внутриклеточных белков. МНС класса II присутствует только на «профессиональных» антиген-презентирующих клетках (АРС), — например, В, дендритных и макрофагах. В их состав входят «чужие» пептиды — части антигена от патогена, которые демонстрируются клеткам иммунной системы, чтобы те знали, с кем бороться.
Главный комплекс гистосовместимости (Major histocompatibility complex – MHC). Инфографика: José A. Villadangos & Petra Schnorrer / Nature Reviews Immunology, перевод: МедНовости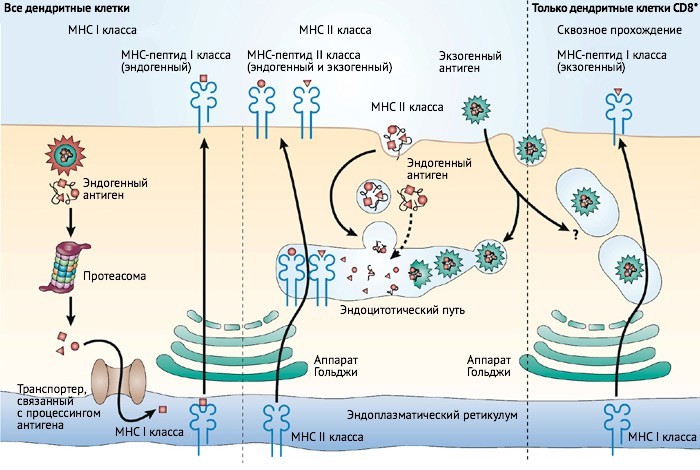
Генетические изменения МНС класса I, например, связывают с такими аутоиммунными заболеваниями суставов, как псориатический артрит, анкилозирующий спондилит. МНС класса II — с ревматоидным артритом, ювенильным идиопатическим артритом.
Блокада провоспалительного фактора некроза опухолей (ФНО, или TNF) на фоне его гиперэкспрессии показала хорошие результаты при ревматоидном артрите и болезни Крона. Кроме того, анти-ФНО терапия эффективна и у многих пациентов с ювенильным ревматоидным артритом, язвенным колитом, псориазом, псориатическим артритом и анкилозирующим спондилитом.
Были обнаружены и другие полиморфизмы предрасположенности к аутоиммуным заболеваниям, например, IRF5, STAT4, bank1, PTPN22, IL23R и ICAM3.
Накапливается все больше данных, что изменение кишечной микробиоты тоже связано с аутоиммунными болезнями. Например, экспансия Prevotella copri из кишечника коррелирует с недавно обнаруженным ревматоидным артритом. Похожие данные получают и в моделях на животных: генетические факторы влияют на кишечную флору, а та, в свою очередь, изменяет риски развития аутоиммунных заболеваний.
Еще одна группа генов, которые могут повысить риски развития болезни, не человеческие. Не секрет, что у большинства европейцев 1-4% генома — от неандертальцев. Как говорят исследования, такие гены могут быть связаны с развитием диабета, системной красной волчанки, билиарного цирроза печени и болезни Крона. Предполагается, что в организме неандертальцев эти части ДНК играли другую роль. Однако результат попадания в геном современного человека, при том что образ жизни изменился за тысячи лет, оказался неблагоприятным. Одним из последствий может быть слишком бурная реакция иммунной системы на те угрозы, которые больше не актуальны, — например, на паразитических червей.
В прошлом году коллаборация ученых из ведущих университетов Америки разработала новую математическую методику для более глубокого исследования существующих баз данных по ДНК. Применив свою технологию на 39 крупных GWAS по 21 аутоиммунному заболеванию, они обнаружили, что большинство важнейших изменений ДНК, ведущих к этим болезням, происходят в энхансерах. Авторы считают, что генетические вариации могут так менять функцию Т-хэлперов, что риск атаки на свой организм увеличивается. В дальнейшем исследователи намереваются выяснить, можно ли смягчить генетические «дефекты» с помощью генной технологии редактирования CRISPR.
Несколько лет назад ученые открыли систему защиты бактерий, распознающую и разрушающую ДНК нападающих вирусов. Созданная на ее основе технология редактирования ДНК CRISPR успешно исследуется в лабораториях, но введение в клиническую практику зависит от того, удастся ли применить ее в организме человека. В случае успеха это откроет путь к лечению генетических причин болезней.
Помимо отдельных генов, как оказалось, на предрасположенность к аутоиммунных заболеваниям влияет и пол. Давно известно, что аутоиммунные заболевания чаще встречаются у женщин. Теперь ученые Стэнфордского университета (Stanford University) смогли показать, что пол — действительно важный фактор для развития болезни на уровне регуляции включения-выключения генов. Для этого использовался новый метод ATAC-seq, который позволяет напрямую изучать молекулы, которые регулируют работу гена. Исследователи изучили экспрессию 500 генов в Т-клетках из крови 12 здоровых волонтеров. Оказалось, что «выключенность» или «включенность» 7% генов этих иммунных клеток варьируется между людьми, сохраняется уникальной на длительное время и даже может служить своеобразным аналогом «отпечатка пальца». Но, несмотря на все различия, главным фактором, влияющим на режим работы генов, был пол. Возможно, его влияние было даже важнее, чем совокупность всех остальных факторов, которые рассматривались в исследовании.
Помимо этого, более трети различий в экспрессии генов между людьми не объясняются генетикой. Вполне возможно, что эти нахождения вызваны внешними факторами, например, питанием или уровнем стресса. Эти данные объясняют ситуацию, когда только у одного близнеца из пары развивается аутоиммунное заболевание.
Эпигенетика
Эпигенетическая регуляция крайне важна для работы и контроля функции гена. В то же время она и очень чувствительна к внешним воздействиям. С развитием аутоиммунных заболеваний связывают такие нарушения эпигенетики, как метилирование ДНК, меняющее работу гена путем «навешивания» химической группы; модификацию гистонов — белков, поддерживающих компактную упаковку ДНК; некодирующую экспрессию РНК.
Эпигенетические механизмы: как внешние факторы влияют на ДНК. Инфографика: National Institutes of Health, перевод: МедНовости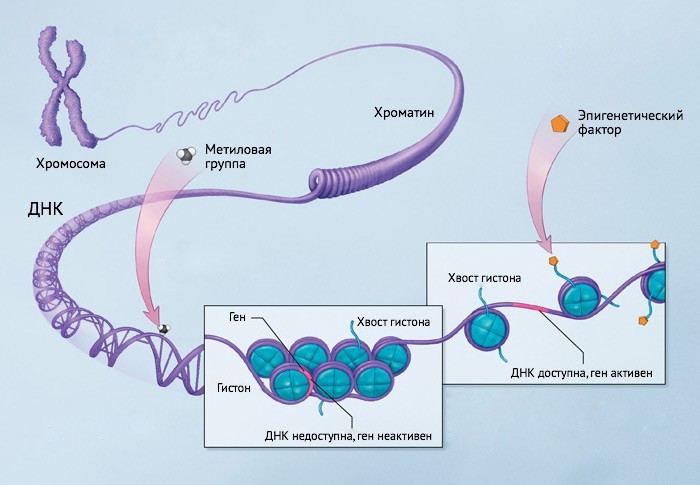
Влияние образа жизни на эпигенетику подтверждают не только исследование из Стэнфордского университета. В 2014 году ученые систематически проанализировали 329 исследований разных стран по отношениям между между ожирением, адипокинами (гормонами жировой ткани) и болезнями, связанными с иммунитетом. Оказалось, что адипокины участвуют в патогенезе таких заболеваний, как ревматоидный артрит, рассеянный склероз, сахарный диабет первого типа, псориаз, воспалительное заболевание кишечника, псориатический артрит и тиреоидит Хашимото. "У нас был длинный список причин аутоиммунных расстройств: инфекции, курение, пестициды, недостаток витаминов и прочее. Но за последние пять лет появился новый фактор, который невозможно игнорировать, — ожирение«,— комментирует руководитель исследования Иехуда Шонфельд (Yehuda Shoenfeld). Помимо этого, результатом ожирения оказался дефицит витамина D.
Проблема «заедания» стресса знакома многим. Сейчас ученые обнаружили, как меняется обмен веществ и количество съеденной пищи в ответ на напряжение. Оказалось, что жировая ткань посылает сигналы в мозг о регуляции метаболизма и о том, как организм справляется со стрессом. Это же может повлиять и на количество поглощаемой пищи. За это ответственны рецепторы глюкокортиктоидов, которые среди прочего регулируют экспрессию генов, контролирующих реакцию тела на стресс.
Аутоиммунное заболевание может спровоцировать и слишком большое потребление соли. В нескольких работах было показано, что некоторые формы этих болезней ассоциированы с повышенным количеством иммунных клеток Т-хэлперов 17 (Th17), секретирующих интерлейкин 17 и другие цитокины, участвующие в иммунном ответе. Ученые из Массачусетского технологического института (Massachusetts Institute of Technology), использовав технологию манипулирования генами исследователей из Гарвардского университета (Harvard University) в Кембридже, показали, что при культивировании мышиных клеток в среде с повышенной соленостью увеличиваются экспрессия SGK1 (serum glucocorticoid kinase 1), которая регулируют концентрацию хлористого натрия, и количество Th17.
Было показано и в мышиной модели рассеянного склероза, что на диете с высоким потреблением соли ускоряется прогрессирование болезни. Ученые пока остерегаются давать жесткие заключения насчет человека, но, как разумно отмечает Дэвид Хафлер (David Hafler) из Йельского университета, руководитель одной из работ, питание с низким содержанием соли в любом случае полезнее.
Доктор Стэйси Банерджи (Stacy Banerjee) из Salusity, компании дистанционного мониторинга хронических заболеваний, говорит, что стресс может привести к обострению болезни Крона, ревматоидного артрита и псориаза.
Исследователи из Корнельского университета (Cornell University) использовали животную модель для изучения рассеянного склероза. Оказалось, что мыши, получавшие дозу кофеина, эквивалентную шести — восьми чашкам кофе в день для человека, были защищены от развития вызванного аутоиммунного энцефаломиелита, животного аналога рассеянного склероза. Ученые объясняют это тем, что кофеин — известный блокатор рецептора аденозина, связанного с инфильтрацией центральной нервной системы иммунными клетками.
 Врачи говорят
Клещевые инфекции — чем опасен анаплазмоз? Объясняет врач
Врачи говорят
Клещевые инфекции — чем опасен анаплазмоз? Объясняет врач
 Как правильно
Что может сделать борщевик человеку? Объясняем по науке
Как правильно
Что может сделать борщевик человеку? Объясняем по науке